Les composés alpha dicarbonylés et leur utilisation en vapologie. Le cas de l’acétoïne.
Depuis quelques années, l’essor de la cigarette électronique est indéniable et permet à de nombreux utilisateurs de consommer de la nicotine par un moyen alternatif au tabagisme. Cependant, la démocratisation de son utilisation soulève de nouvelles interrogations de santé publique notamment sur l’inhalation de certaines molécules contenues dans les arômes alimentaires vaporisés.
C’est le cas de la famille des alpha-dicarbonyles et plus particulièrement du 2,3-butanedione ou diacétyle (DA) et du 2,3-pentanedione ou acétyle propionyl (AP), deux alpha-dicétones de cette famille. Les industries agroalimentaire et pharmaceutique les utilisent en tant qu’agents de saveur pour leurs notes beurrées, crémeuses et laiteuses1. Inoffensives en ingestion, elles présenteraient un potentiel toxique et contribueraient au développement de pathologies respiratoires une fois inhalées. En effet, une étude d’envergure du « National Institute for Occupational Safety and Health » (NIOSH)2 établit un lien entre l’inhalation quotidienne de ces molécules et la diminution des capacités respiratoires chez les travailleurs de l’industrie du popcorn. Leurs conclusions ont abouti à l’établissement de valeurs limites d’expositions professionnelles sur le diacétyle (DA) et l’acétyle propionyl (AP).
Comme le montre le Dr. Farsalinos dans une publication en 20143, l’utilisation du DA et de l’AP est largement répandue dans les arômes agroalimentaires utilisés pour la fabrication des e-liquides et plus particulièrement dans les e-liquides type « custard ». Afin d’assurer la continuité du développement de la cigarette électronique, il est essentiel pour la filière de comprendre l’origine de la toxicité de ces molécules ainsi que les problématiques liées à leur utilisation en tant que saveur dans les e-liquides.
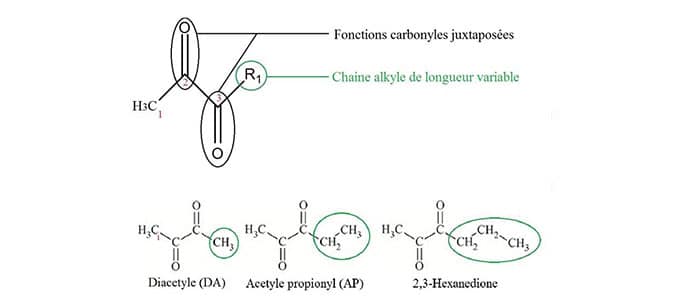
Représentation chimique caractéristique des 2,3-alpha-dicarbonyles et de trois molécules appartenant à cette famille moléculaire.
Relation entre structure et réactivité des alpha-dicarbonyles
La structure chimique générale des alpha-dicarbonyles et de quelques-unes des molécules de cette famille sont présentées en figure 2.
La fonction carbonyle est formée par l’association d’un atome de carbone et d’un atome d’oxygène liés par une double liaison. Lorsque deux fonctions carbonyles sont juxtaposées, c’est-à-dire que les deux carbones impliqués dans ces fonctions sont liés entre eux, on parle d’alpha-dicarbonyles. Une chaîne alkyle se caractérise par une suite d’atomes de carbones liés seulement à des atomes d’hydrogènes. Les molécules présentées en figure 2 sont donc composées d’un groupe dicarbonyle et d’une chaîne alkyle dont la longueur varie.
La juxtaposition de deux fonctions carbonyles a pour effet d’augmenter la réactivité de chacune d’elle4. De plus, il semblerait que les différences structurales des alpha-dicarbonyles au niveau de la longueur de leur chaine alkyle confèrent des réactivités et des propriétés différentes à ces molécules 5.
Interactions des alpha-dicarbonyles avec l’organisme
La réactivité d’une molécule peut se comprendre comme la facilité avec laquelle la molécule va réagir avec une autre. La réactivité des alpha-dicarbonyles est fonction de la longueur de leur chaine alkyle et par conséquent de leur taille. Ainsi le DA (4 carbones) sera plus réactif que l’AP (5 carbones) qui sera lui-même plus réactif que le 2,3-hexanedione (6 carbones).
Il faut distinguer deux types d’interactions entre cette famille moléculaire et l’organisme :
- l’interaction avec les récepteurs sensoriels qui se traduira par la perception de la saveur induite par la molécule,
- l’interaction avec les protéines des cellules en surface des poumons et plus particulièrement avec celles de la paroi des bronchioles qui se traduira par la toxicité en inhalation de ces molécules.
Les alpha-dicarbonyles ont tendance à se lier aux protéines par réaction d’une de leur fonction carbonyle avec deux acides aminés particuliers, généralement situés à l’extérieur des protéines (arginine et lysine)2. Cette réaction chimique forme ce que l’on nomme une « base de schiff » (figure 3).
Cette réaction est également utilisée pour la dérivation des alpha-dicarbonyles dans de nombreuses méthodes analytiques de quantification de ces composés 6,7. Un exemple de dérivation des alpha-dicarbonyle par du diaminobenzène est présenté en figure 3. Les complexes ainsi formés peuvent ensuite être détectés plus aisément que les molécules non dérivées.
Par l’intermédiaire de cette même réaction chimique, les alpha-dicarbonyles sont capables d’inactiver des enzymes8. En modifiant la structure tridimensionnelle de l’enzyme, les alpha-dicarbonyles l’empêchent d’assurer sa fonction. Il est probable que lorsqu’une grosse partie des enzymes d’une cellule est inactivée, cela induit une mortalité cellulaire. A l’échelle d’un tissu organique, cela se traduit par une forte inflammation pouvant provoquer une fibrose. Lorsque la paroi bronchioliaire est atteinte, la personne développera des pathologies respiratoires comme des bronchiolites oblitérantes9 qui entraîneront la diminution des capacités respiratoires de l’individu.
Nous avons vu que la réactivité des alpha-dicarbonyles augmente avec la diminution de leur taille. Comme c’est la réactivité de cette famille moléculaire qui induit leur toxicité, on peut penser que plus le dicarbonyle sera petit, plus il sera réactif et donc plus il sera nocif. Autrement dit le 2,3hexanedione sera moins nocif que l’AP qui sera lui-même moins nocif que le DA. Enfin, la nocivité des alpha-dicarbonyles est proportionnelle à leur concentration et on dit que leur effet est « dose-dépendant ».
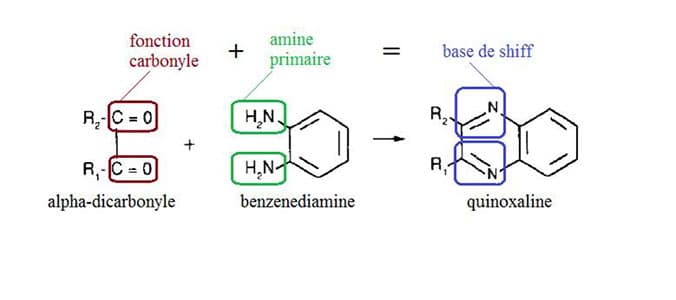
Réaction utilisée pour la dérivation des alpha-dicarbonyles avec le benzenediamine. Production d’un dérivé quinoxaline par formation de deux bases de shiff.
Problématiques posées par l’utilisation des alpha-dicarbonyles en tant que saveurs dans les e-liquides
Historiquement l’utilisation de l’AP fit suite aux doutes soulevés quant à la toxicité du DA en inhalation. Cependant, bien que le DA et AP présentent des notes aromatiques similaires, leur seuil de détection respectif est différent. Plus précisément, l’AP nécessite d’être en plus grande concentration (20 ng/mL) que le DA (5 ng/mL) pour être perçu gustativement1.
Ainsi lorsque l’on veut remplacer le DA dans la formulation d’un e-liquide par de l’AP sans en changer la saveur, il faut utiliser une quantité d’AP plus importante que la quantité de DA remplacée. En se basant sur leur seuil de détection, il faudrait environ 4 fois plus d’AP que de DA pour avoir le même rendu gustatif.
Ceci s’explique par la différence de réactivité qu’il existe entre les deux molécules. En effet, on peut penser que l’interaction de l’AP avec les récepteurs sensoriels est moins favorable que celle du DA avec ces mêmes récepteurs. Par conséquent pour des quantités identiques, l’AP produira des sensations gustatives moins intenses que le DA.
Les résultats d’analyses menées sur des e-liquides par le Dr. Farsalinos 3 d’une part et par notre laboratoire d’autre part semble soutenir cette hypothèse. En effet, les mesures effectuées sur des e-liquides qui contiennent ces molécules montrent qu’en moyenne l’AP est présent en plus grande quantité que le DA.
Il est donc nécessaire de tenir compte du rapport puissance gustative/toxicité des deux molécules lors du remplacement du DA par de l’AP.
Enfin, depuis peu nous constatons qu’une infime partie des e-liquides aux saveurs « gourmandes » qui se veulent sans DA et sans AP, utilisent le 2,3-hexanedione pour conserver leurs notes beurré et crémeuse. On peut étendre le raisonnement « puissance gustative/toxicité » au 2,3hexanedione, dont la structure chimique indique une plus faible réactivité, mais dont les notes aromatiques sont similaires à celles du DA et de l’AP 1. Il est donc dangereux de réaliser cette substitution car bien que moins toxique que le DA et l’AP, le 2,3hexanedione nécessite d’être beaucoup plus concentré (10 à 100 fois plus) afin de conserver la saveur de l’e-liquide. Ce remplacement pourrait contribuer à augmenter la toxicité de la solution en inhalation et ceci malgré l’absence de DA et d’AP dans l’e-liquide.
Cas de l’utilisation de l’acétoine comme substituant du DA et de l’AP
L’acétoine ou 2-hydroxy-3-butanone (figure 4), ne fait pas partie de la famille des alpha-dicarbonyles mais lui est structurellement très proche. Utilisé dans les arômes d’e-liquides, il confère des notes aromatiques très similaires à celles données par les alpha-dicarbonyles.
Bien que sa toxicité ne soit pas avérée en inhalation, le National institute for occupational safety and health la classe dans les molécules à surveiller lorsqu’elles sont inhalées 2. De plus il possède une limite de détection aromatique nettement supérieure à celle des alpha-dicarbonyles (100 à 150 fois supérieure). Par conséquent, son utilisation en tant que molécule aromatique dans les e-liquides impose de grandes concentrations pour ne pas affecter la saveur de la solution. Pour les raisons expliquées ci-dessus, ceci pourrait contribuer à l’augmentation de la nocivité de l’e-liquide résultant.
De plus, l’acétoine et le DA étant structurellement très proches, il est impossible de conclure quant à l’absence de sa transformation en DA dans le temps. Cette conversion a déjà était observée dans certaines conditions expérimentales10 et permet de penser qu’elle pourrait également survenir dans la matrice d’un e-liquide. Des analyses préliminaires internes sur des solutions pures d’acétoine utilisées pour la conception des arômes des e-liquides, provenant de différents fournisseurs tendent à montrer une légère contamination des solutions par du DA. Si cette contamination est confirmée, il se pourrait que de nombreux arômes supposés sans DA mais contenant une grande quantité d’acétoine, contiennent en réalité une concentration en DA non négligeable. Afin de résoudre ce problème nous avons engagé une série de mesures sur diverses solutions d’acétoine, ainsi que sur des e-liquides en contenant de grandes quantités. Nous réalisons également des mesures sur une même solution ou e-liquide à intervalles réguliers afin d’observer une éventuelle transformation de l’acétoine en DA dans la matrice d’un e-liquide ou d’un arôme.
Il est possible que la contamination des solutions aromatiques par du DA ne soit pas limitée à l’acétoine car le DA est utilisé comme intermédiaire réactionnel dans la synthèse chimique de diverses molécules aromatiques 2.
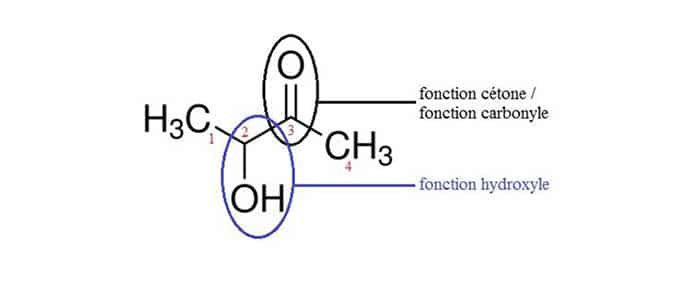
Représentation chimique de l’acétoine (2-hydroxy-3-butanone)
Conclusion
Nous avons vu que l’importante réactivité des alpha-dicarbonyles provenait de leur structure chimique spécifique. Cette réactivité leur permet de se lier à des enzymes, inhibant de ce fait leurs fonctions; ceci pouvant conduire au développement de pathologies impliquant une diminution de la capacité respiratoire de l’individu.
Bien que similaires en terme de saveur, les alpha-dicarbonyles possèdent des seuils de détection différents et l’intensité des sensations gustatives qu’elles produisent varie lors de l’inhalation de quantités identiques. Lors du remplacement d’un alpha-dicarbonyle par un autre ou par une molécule similaire telle que l’acétoine il est essentiel de considérer le rapport puissance gustative/toxicité des molécules afin d’anticiper la toxicité potentielle du e-liquide contenant ces molécules.
Il faut distinguer deux raisons pour lesquelles il est possible de retrouver du DA dans un e-liquide :
- Celui-ci peut être introduit volontairement pour ces propriétés gustatives : il sera alors en quantité relativement importante.
- Il peut également être introduit par inadvertance lors de l’utilisation d’une autre solution aromatique qui pourrait être contaminée par une petite quantité de DA.
Enfin, il est important de relativiser les risques liés à l’inhalation des alpha-dicarbonyles lors de l’utilisation d’une cigarette électronique. En effet, le DA et l’AP sont également présents dans la fumée de cigarette et le tabagisme n’est pas un facteur de risque pour le développement de bronchites oblitérantes. Les études mettant en évidence le lien de cause à effet qu’il existe entre l’inhalation d’alpha-dicarbonyles et le développement de pathologies respiratoires ont étudié la qualité de l’air ambiant. Ces études ont pour but de caractériser l’exposition professionnelle aux alpha-dicarbonyles, c’est pourquoi elles supposent une inhalation constante de ces molécules 40 heures par semaine (8h/j ; 5/7j) 2. Or, il est difficile de comparer la toxicité due à l’inhalation ponctuelle de vapeur de cigarette électronique contenant des alpha-dicarbonyles avec celle d’une respiration constante de l’air chargé en alpha-dicarbonyles 3.
Définitions
Acides aminés
Ce sont des molécules qui s’associent entre elles, en respectant le code génétique, pour former des complexes chimiques appelés protéines. A l’image des acides nucléiques pour l’ADN (bases A ; T ; G ; C), ils sont les constituants élémentaires des protéines. Chacun des 22 acides aminés donne à la protéine des propriétés chimiques spécifiques et l’ordre d’assemblage lui donne une fonction bien précise.
Protéines
Ce sont des complexes macromoléculaires composés d’une ou plusieurs chaînes d’acides aminés. Elles assurent diverses fonctions au sein de l’organisme, comme par exemple :
- Enzymatique (ex : Glucokinase, première enzyme de la glycolyse, voie métabolique pour l’assimilation du glucose)
- Structural (ex : Collagène, famille de protéines structurales)
- Hormonal (ex : Insuline, hormone impliquée dans la régulation de la glycémie)
- Moteur (ex : Myosine, protéine impliquée dans la contraction musculaire)
Enzymes
Ce sont des protéines qui jouent le rôle de catalyseur biologique, en rendant possible ou en facilitant une réaction biochimique (réaction chimique au sein d’organisme vivant). L’ensemble des réactions biochimiques catalysées par les enzymes est appelé métabolisme.
Fibrose
La fibrose désigne la transformation d’un tissu sain en un tissu composé de fibres, proche du tissu conjonctif ou cicatriciel. Elle intervient souvent à la suite d’une lésion tissulaire ou d’une inflammation d’un tissu incapable de se régénérer correctement : les tissus initialement sains sont alors remplacés par un tissu fibreux.
Bronchiolites oblitérantes
Réduction de la taille de la bronchiole (figure 1) souvent associée à une diminution des capacités respiratoires. Ceci majoritairement causé par une inflammation ou une fibrose de la paroi de la bronchiole.
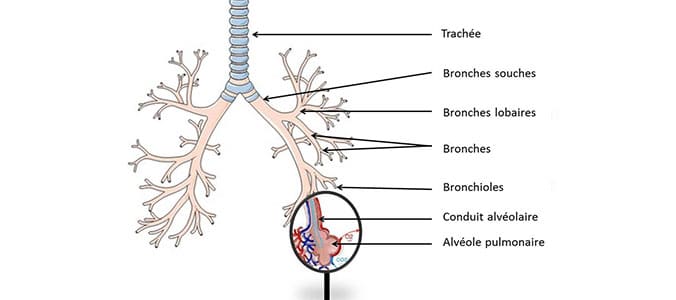
Schéma des voies respiratoires inférieures, l’arbre bronchique.
Références
- Burdock G.A. Fernoli’s hand book of flavor ingredients (sixth edition). CRC Press Taylor & Francis Group
- National Institute for Occupational Safety and Health (NIOSH). (2011). Criteria for a recommended standard: Occupational Exposure to Diacetyl and 2,3-Pentanedione.
- Farsalinos E. K. et al. (2015) Evaluation of electronic cigarette liquids and aerosol for the presence of selected inhalation toxins. Nicotine Tob Res 17 (2):168-174.
- Nakagawa J. et al. (2002). Molecular characterization of mammalian dicarbonyl/L-xylulose reductase and its localization in kidney. J Biol Chem 277(20):17883–17891.
- Roberts DW. et al. (1999). Structure-activity relationships in the murine local lymph node assay for skin sensitization: alpha,beta-diketones. Contact Dermatitis 41(1):14–17.
- Bednarski W. et al. (1989) A Method for the Determination of a-Dicarbonyl Compounds. I Dai~ Sci 72:2474-2477
- Pingliang L. et al. (2012). Development and Validation of a High-Performance Liquid Chromatography Method for the Determination of Diacetyl in Beer. Using 4-Nitro-o-phenylenediamine as the Derivatization Reagent. J. Agric. Food Chem. 60, 3013−3019
- Saraiva MA. et al (2006). Non-enzymatic model glycation reactions: a comprehensive study of the reactivity of a modified arginine with aldehydic and diketonic dicarbonyl compounds by electrospray mass spectrometry. J Mass Spectrom 41(6):755–770.
- Morgan DL, et al. (2010). Inhalation toxicity of acetyl proprionyl in rats and mice. Toxicol Sci (The Toxicologist) Suppl 114 (1):316.
- Pensergrass S.M. (2004). Method development for the determination of diacetyl and acetoin at a microwave popcorn plant. Environ. Sci. Technol. 38, 858-861










Aucun commentaire
Soyez le premier à laisser un commentaire